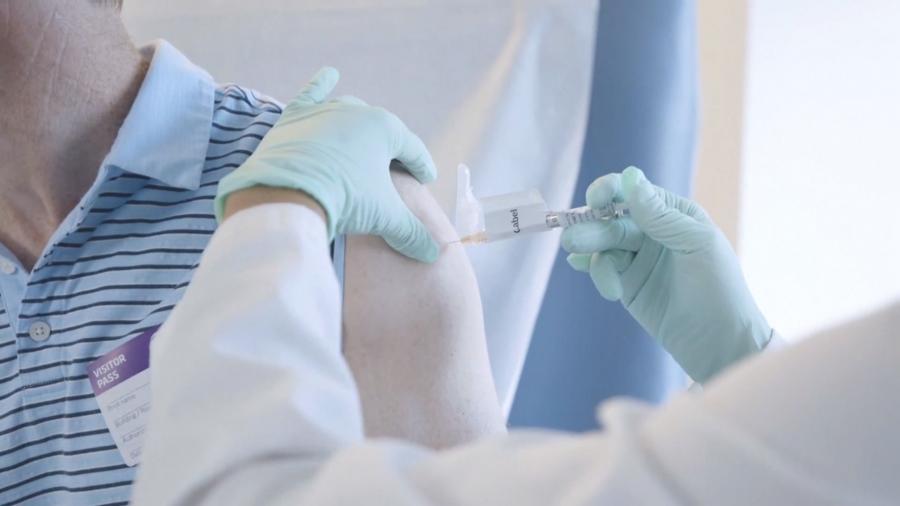
輝瑞BNT疫苗防護力達95% 將申請緊急使用授權
發布時間:
更新時間:
美國輝瑞和德國BNT研發的疫苗,在後期實驗結果顯示防護力達95%,將申請美國的FDA緊急使用授權。跟莫德納的疫苗一樣,都有機會在12月獲得批准。至於美國FDA也在17日批准第一套「在家快篩套組」的緊急使用授權,可以在30分鐘之內得知結果。
總部位在美國加州的生技公司Lucira ,研發出家用新冠病毒快速檢測試劑,17日成為美國首個獲得食品藥物管理局FDA緊急使用授權的快篩套組。使用者只要用鼻咽拭子採集樣本放在小瓶子內,插入一個小型檢驗裝置,30分鐘內會亮燈顯示結果。
總部位在美國加州的生技公司Lucira ,研發出家用新冠病毒快速檢測試劑,17日成為美國首個獲得食品藥物管理局FDA緊急使用授權的快篩套組。使用者只要用鼻咽拭子採集樣本放在小瓶子內,插入一個小型檢驗裝置,30分鐘內會亮燈顯示結果。
這個套組適用在14歲以上人士,需要處方才能使用,售價50美元,約台幣1500多元。
薩特醫療集團醫師周約翰表示,「最大的進步不僅是快速,還包括能夠等同於或趨近於我們所認定的黃金標準,也就是PCR聚合酶連鎖反應測試。」
而疫苗研發也有好消息,美國輝瑞藥廠與德國生技公司BNT合作研發的兩劑式疫苗,18日公布後期實驗最終結果,顯示疫苗防護力達到95%,且具良好耐受性,大多數只有輕微到溫和的副作用,很快就消失,唯一比較嚴重的不適是疲倦感。
薩特醫療集團醫師周約翰表示,「最大的進步不僅是快速,還包括能夠等同於或趨近於我們所認定的黃金標準,也就是PCR聚合酶連鎖反應測試。」
而疫苗研發也有好消息,美國輝瑞藥廠與德國生技公司BNT合作研發的兩劑式疫苗,18日公布後期實驗最終結果,顯示疫苗防護力達到95%,且具良好耐受性,大多數只有輕微到溫和的副作用,很快就消失,唯一比較嚴重的不適是疲倦感。
最終數據顯示,疫苗在各年齡層和種族的預防效果一致,代表可望在全球廣泛使用,而且對年齡65歲以上高齡族群也很有效。
BioNTech共同創辦人暨執行長沙辛說明,「對65歲以上老人的保護力達到94%以上,這是很重要的發現,因為這個族群,銀髮族是新冠病毒重症高危險群。」
輝瑞表示,公司已經取得所需的2個月安全性數據,近日將向歐洲跟美國FDA申請緊急使用權,預計12月中旬之前可獲得批准。面對疫苗必須使用攝氏零下70度冷鏈技術保存運送的技術難題,BNT執行長沙辛表示,三個月內肯定能提出較可行的配送溫度。
另外一家候選疫苗先驅者莫德納,預計也將在11月25日之前,向美國FDA申請緊急使用授權。美國政府疫苗與療法研發計畫,「神速行動」的最高主管施勞威表示,輝瑞與莫德納的兩支疫苗,預計幾個禮拜內就會先後獲得緊急使用授權,批准後24小時內就會開始分發疫苗。兩家業者都加緊生產,預計年底前可備妥4000萬劑,供2000萬美國人接種。
關於疫苗即將問世,美國民眾各有不同看法,有的認為終於看到疫情隧道盡頭的曙光,是最佳耶誕禮物;也有人謹慎表示要多觀察,完全確認安全性再決定是否接種。
BioNTech共同創辦人暨執行長沙辛說明,「對65歲以上老人的保護力達到94%以上,這是很重要的發現,因為這個族群,銀髮族是新冠病毒重症高危險群。」
輝瑞表示,公司已經取得所需的2個月安全性數據,近日將向歐洲跟美國FDA申請緊急使用權,預計12月中旬之前可獲得批准。面對疫苗必須使用攝氏零下70度冷鏈技術保存運送的技術難題,BNT執行長沙辛表示,三個月內肯定能提出較可行的配送溫度。
另外一家候選疫苗先驅者莫德納,預計也將在11月25日之前,向美國FDA申請緊急使用授權。美國政府疫苗與療法研發計畫,「神速行動」的最高主管施勞威表示,輝瑞與莫德納的兩支疫苗,預計幾個禮拜內就會先後獲得緊急使用授權,批准後24小時內就會開始分發疫苗。兩家業者都加緊生產,預計年底前可備妥4000萬劑,供2000萬美國人接種。
關於疫苗即將問世,美國民眾各有不同看法,有的認為終於看到疫情隧道盡頭的曙光,是最佳耶誕禮物;也有人謹慎表示要多觀察,完全確認安全性再決定是否接種。